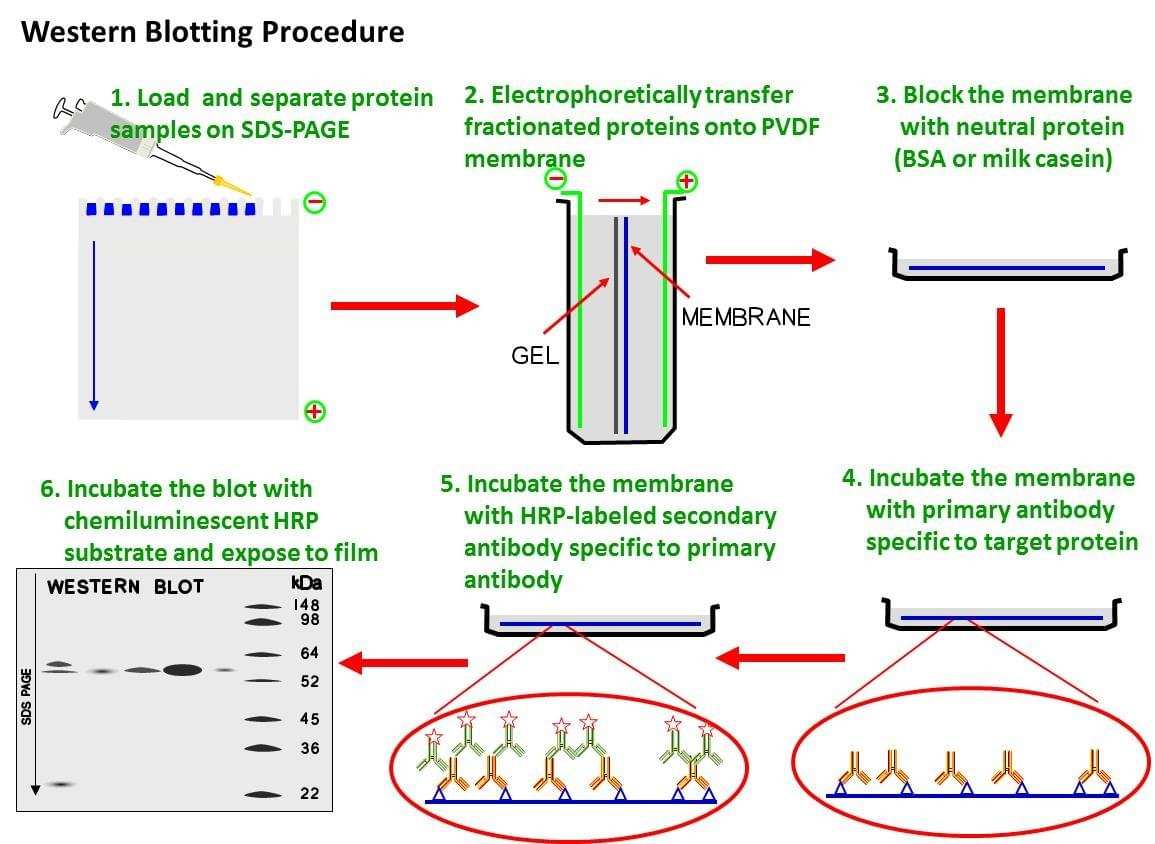
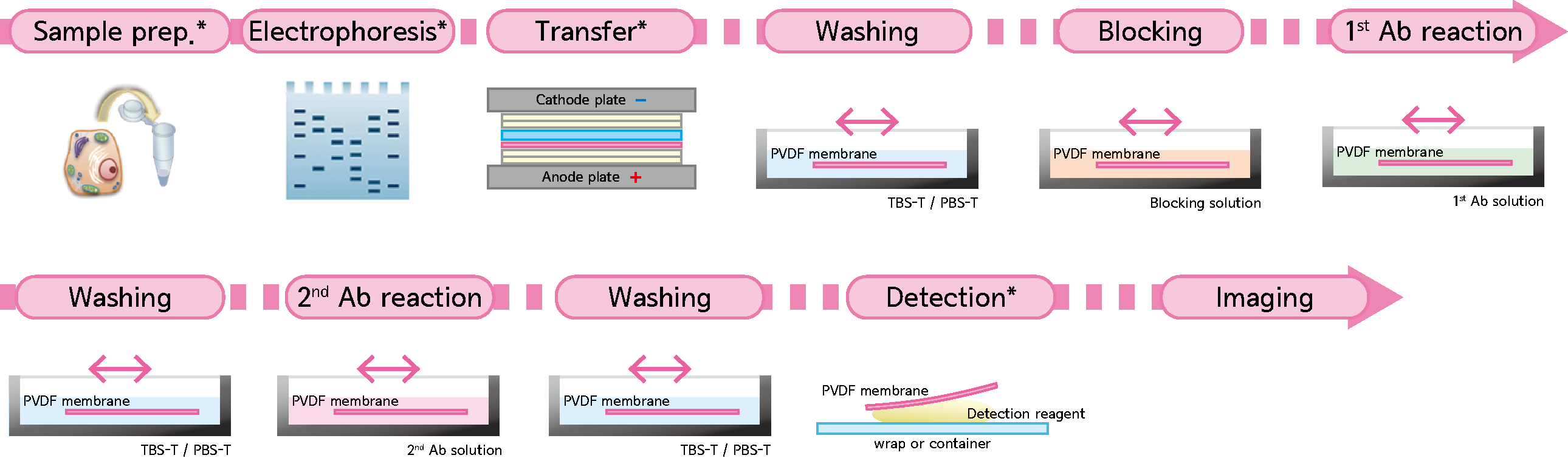
결과 보고서 실험 제목:western-blot transfer이후의 과정 실험 목적:western blot의 transfer이후의 과정, 즉 blocking과정에서 detection까지 수행하면서 단백질 정량을 측정하는 방법을 배움으로써 membrane이 marker과 비교하며 반응을 확인한다.실험일:22.12.02실험 내용:1)Blocking the membrane Blocking soluion을 준비한다:5%non-fat dry milk과 TBST를 mix한 solution Membrane을 Blocking solution에서 1시간 incubate을 가져2)Primary antibody우리가 사용하는 antibody(actin, mouse)을 준비하는 Blocking solution에 1:1000에서 dilute 한다. Membrane을 비닐에 넣어 밀봉한 뒤 1차 antibody로 만든 위의 solution 1ml를 넣는다.섭씨 4도에서 overnight incubate 한다.
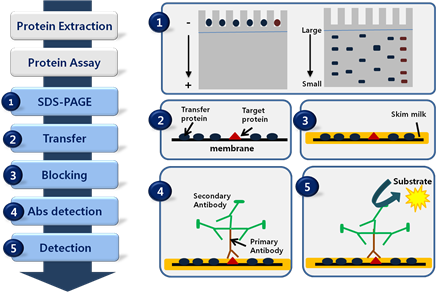
TBS T buffer 에서 10분간 잠글 정도로 shaker에 놓은 후 버리는 것을 4번 반복한다(wash)

3) 2차항체 HRP가 결합체 2차항체(항마우스,염소)
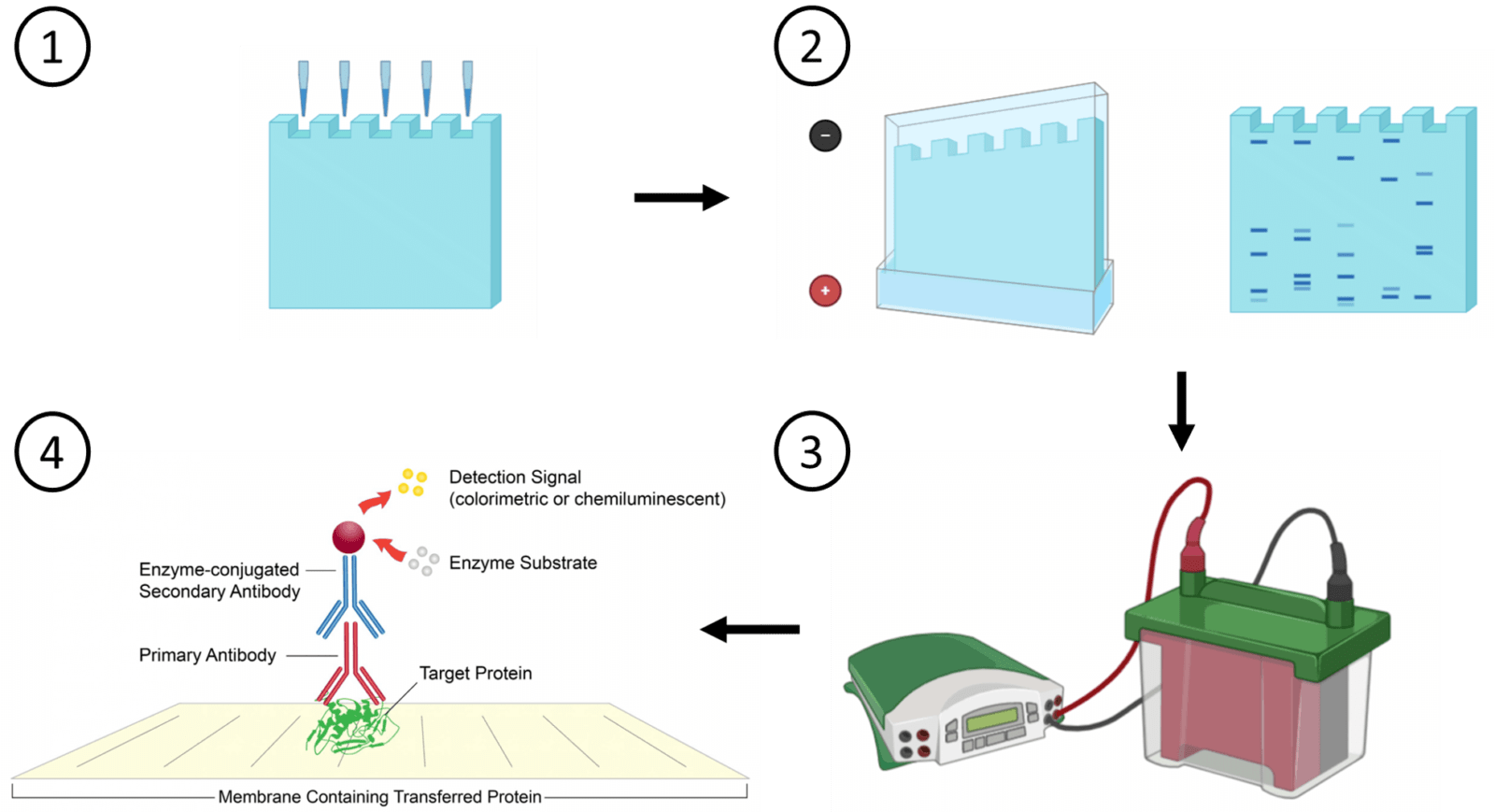
블록 솔루션에 1:1000으로 dilute 시킵니다.Membrane을 비닐에 넣고 밀봉한 후 1차 antibody로 만든 위의 solution 1ml를 넣습니다.Membrane을 Blocking solution으로 1시간 동안 incubate로 진행합니다 TST buffer에서 10분간 잠글 정도로 shaker에 놓은 후 버리기를 4번 반복(wash)4) Detection ECL kit에서 reagent A와 reagent B를 0.5ml씩 1:1로 섞어 총 1ml volume을 만듭니다
Membrane에 위 용액을 뿌려 membrane 전체를 적신다.3분간 incubation을 수행한 후 과량을 빼낸 후 western blot imaging machine을 통해 film을 인쇄한다. (imaging)실험결과
토의 및 분석 1) 결과 분석
위의 사진에서 제일 왼쪽이 imaging결과이다.아래쪽에서 밴드가 절단면에 베인 것이 확인할 수 있다.이것은 최초의 1차 antibody를 처리하기 전에 membrane에서 우리가 원하는 부분을 잘라내때 여유를 갖고 자르지 못했기 때문이라고 생각한다.가운데 있는 사진이 marker protocol에 있는 사진이다.우리가 보기로 했던 단백질인 actin은 크기가 약 40정도여서, 노란 색으로 절단면을 표시한 만큼 끊었지만, 자르는 과정에서 marker기준 41에 좀 여유를 뒀어야 했다.3번째 membrane에서 보면 절단면이 41marker band에 밀착하고 있음을 확인할 수 있다만약 정상적으로 결과가 나왔다면 5µ l샘플에서는 marker40정도의 크기로 얇은 band가 같은 위치에서 10µ l인 샘플 위치에서는 좀 더 짙은 band가 나와야 한다.우리의 결과가 약간 특이한 것은 marker기준 53에서 68사이의 위치에서 희미한 밴드가 나왔다는 점이다.아마 이것은 우리가 target한 단백질 이외의 membrane자체 내의 단백질이 반응하거나 실험 과정 중의 contamination을 의심하고 볼 수도 있을 것 같다.2)2차 antibody의 선택 속에서 고려해야 할 사항, 우리는 1차 antibody를 host가 mouse인 antibody로 선정했다.2차 antibody를 선정할 때는 1차 antibody에 붙도록 1차 antibody의 host를 고려하고 다른 host의 antibody를 2차 antibody로 선정해야 한다.우리는 mouse가 host인 1차 antibody를 사용한 것으로 2차 antibody는 anti-mouse antibody, host이 goat인 antibody를 이용했다.